|
|
|
|
|
|
| Acides aminés | Structure | Rôles | Enzymes | Nutrition | Ce matin, vous avez peut-être mis du sucre dans votre café. Ce sucre, c'est du saccharose, un disaccharide formé de l'union d'un glucose à un fructose. Dans l'eau chaude du café, le saccharose demeure du saccharose, il ne se sépare pas en glucose et fructose. La liaison entre les deux monosaccharides qui le forment est très difficile à briser. Vous pourriez chauffer encore plus votre café ou le brasser vigoureusement pendant un mois, le saccharose va demeurer du saccharose. Pourtant, en arrivant dans votre intestin, le sacharose de votre café s'est presque immédiatement transformé en glucose et en fructose. Si vous placez maintenant dans un peu d'eau chaude du glucose et du fructose et que vous brassez quelques minutes, vous obtiendrez... du glucose et du fructose. Ces deux monosaccharides n'ont pas du tout tendance à s'unir ensemble pour former du saccharose. Pourtant, dans les plantes, tous les jours, des millions de tonnes de glucose se combinent à autant de fructose pour former du saccharose. La réaction se fait facilement et rapidement. Pourquoi?
La réponse à cette énigme tient en un seul mot : enzyme. Les plantes possèdent l'enzyme nécessaire à l'assemblage du glucose et du fructose en saccharose. Votre intestin possède l'enzyme nécessaire pour briser le saccharose en glucose et fructose. Sans ces enzymes, ces réactions simples seraient très difficiles à obtenir. Avec les enzymes appropriées, elles se font facilement. Une enzyme est une protéine qui a dans la cellule une fonction de catalyseur. Un catalyseur est une substance qui modifie la vitesse d'une réaction chimique mais qui se retrouve inchangée à la fin de la réaction. En termes plus techniques, un catalyseur est une substance qui abaisse l'énergie d'activation d'une réaction chimique. |
|
|
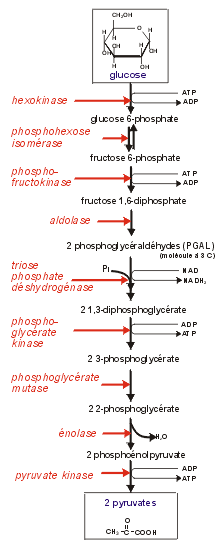
La
glycolyse.
|
La figure de gauche illustre la transformation du glucose en deux molécules de pyruvate. Cette transformation, appelée glycolyse, est une étape importante de la fermentation et de la respiration. Si l'oxygène est absent du milieu, le pyruvate peut être converti en alcool. C'est la fermentation alcoolique caractéristique des levures et de certaines bactéries. En présence d'oxygène, le pyruvate peut se transformer en gaz carbonique et en eau, c'est la respiration. Dans la glycolyse, le glucose est d'abord converti en glucose 6-phosphate. Remarquez l'enzyme (en rouge), l'hexokinase, qui intervient dans la réaction. Sans cette hexokinase, le glucose ne pourrait pas être transformé en glucose 6-P. Le glucose
6-P est ensuite converti en fructose 6-P par une autre
enzyme, la phosphohexo isomérase.
Chaque étape est catalysée par une enzyme spécifique. Si une seule de ces enzymes manquait, la réaction ne pourrait pas se poursuivre jusqu'à la formation du pyruvate. Il n'y aurait plus ni fermentation, ni respiration. Ce serait la mort de la cellule. Notez que généralement le nom des enzymes se termine par le suffixe ase. De plus, le nom de l'enzyme indique souvent ce que fait l'enzyme. Une déshydrogénase, par exemple, enlève un atome d'hydrogène à la molécule sur laquelle elle agit. La lactase digère le lactose en glucose et galactose. Devinez comment s'appelle l'enzyme qui digère le saccharose? Eh oui, la saccharase.
|
|
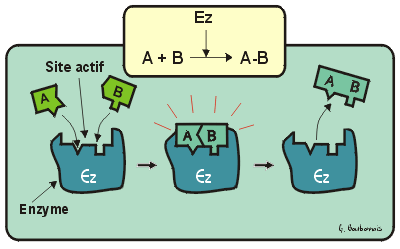
Lorsque la chaîne d'acides aminés se replie sur elle-même, elle forme une structure compacte présentant des creux et des bosses. Dans certains creux se trouvent réunis des acides aminés qui, ensemble, confèrent à cette région de la protéine des caractéristiques chimiques spécifiques. C'est au niveau d'une telle région, appelée site actif, que s'effectue la réaction chimique catalysée par une enzyme. Par exemple, c'est en se fixant sur le site actif de la lactase que le lactose se défait en glucose et en galactose. Et il n'y a que le lactose qui peut se fixer sur ce site. Le maltose (c'est un sucre formé de l'union de deux glucoses), par exemple, n'a pas d'affinité chimique avec le site actif de la lactase et il ne peut pas s'y fixer.
L'enzyme illustré ci-dessus catalyse une réaction chimique au cours de laquelle une molécule A se lie à une molécule B pour former la molécule AB. On constate que chacune des deux molécules a une affinité avec le site actif de l'enzyme. Lorsque A et B sont fixées dans le site actif, elles sont exactement dans les bonnes conditioons pour former une liaison entre elles et former AB. À la fin de la réaction, la nouvelle molécule AB se détache de l'enzyme qui, de ce fait, peut à nouveau recommencer la même réaction. L'enzyme n'est pas altérée par la réaction. Une même enzyme peut refaire la même réaction des milliers de fois à la seconde. |
|
||||
|
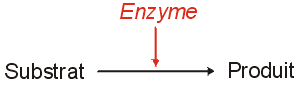
Dans une réaction enzymatique (c'est à dire catalysée par une enzyme), on appelle substrat la ou les substances qui se fixent sur le site actif et produit la ou les molécules obtenues à la fin de la réaction.
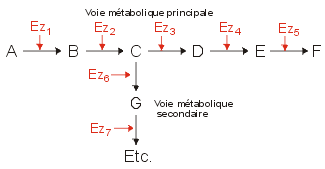
Dans la cellule, les réactions chimiques se font souvent à la chaîne. Le produit d'une première réaction devient le substrat d'une autre réaction dont le produit devient le substrat de la prochaine réaction et ainsi de suite jusqu'à l'obtention d'un produit final. De telles chaînes de réactions sont appelées voies métaboliques.
La glycolyse illustrée ci-dessus n'est qu'une des nombreuses voies métaboliques de l'organisme. Le site The Main Metabolic Pathways on Internet illustre les principales voies métaboliques. Regardez bien cette page. On peut y voir une partie des réactions chimiques qui se déroulent normalement dans une cellule. Vous voyez là la vie ! Vivre, pour une cellule, c'est effectuer ces réactions métaboliques. Ce sont ces réactions qui permettent à la cellule de tirer de l'énergie de la matière ou de fabriquer les substances qui lui fournissent de l'énergie ou qui lui permettent de se réparer et de se reproduire. Chacune des étapes chimiques illustrées est catalysée par une enzyme spécifique (le nom des enzymes est écrit en bleu). Mesurez-vous maintenant l'importance des enzymes pour la vie ?
|
|
|
Si la protéine se déforme, le site actif risque d'être modifié et de devenir alors inactif. L'enzyme a alors perdu ses propriétés catalytiques, elle ne peut plus remplir sa fonction.
C'est
pourquoi la chaleur est mortelle pour les êtres vivants.
Dans une cellule chauffée, les enzymes sont dénaturées
et pratiquement toutes les réactions chimiques qui se déroulent
quand la cellule est vivante s'arrêtent. La cellule devient
chimiquement inerte, elle est morte. C'est également pour
cette raison que les aliments cuits se conservent mieux que les
aliments crus. La cuisson dénature les enzymes des cellules
de l'aliment. Sans enzymes, les réactions de dénaturation
qui se poursuivent même après la mort cessent.
|
|
|
Le site actif de plusieurs enzymes appelées apoenzymes ne peut être fonctionnel que si une substance particulière, le cofacteur vient s'y fixer. Le cofacteur peut être:
La plupart des vitamines sont des coenzymes ou des substances utilisées par la cellule pour fabriquer des coenzymes. L'apoenzyme seule ou le cofacteur seul n'ont pas de propriétés catalytiques. Il faut que les deux soient associés pour que l'enzyme fonctionne.
|
|
|||||||||||
|
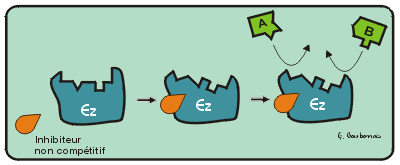
L'activité catalytique d'une enzyme peut diminuer et même complètement s'arrêter au contact de certaines substances chimiques. On reconnaît généralement deux modes d'inhibition différents:
|
|
|
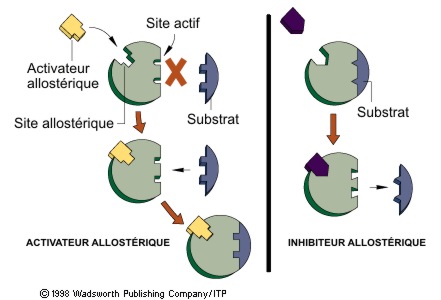
Certaines enzymes dites allostériques (de allos, autre et stereos, site ou espace) possèdent, en plus de leur site actif, un site appelé site allostérique. Une substance appelée effecteur (on dit aussi modulateur ou regulator en anglais) peut se fixer sur ce site. Une enzyme allostérique peut généralement avoir deux formes différentes. Une forme active et une forme inactive. L'effecteur, en se fixant sur son site allostérique, a pour effet de bloquer l'enzyme dans sa forme active ou dans sa forme inactive (ça dépend de l'enzyme). On parle alors d'effecteur inhibiteur et d'effecteur activateur.
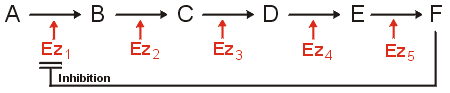
Les effecteurs jouent un rôle important dans le contrôle de l'activité des enzymes dans la cellule. Ex. Dans les chaînes métaboliques, le produit final obtenu en bout de chaîne peut être un effecteur inhibiteur d'une enzyme allostérique du début de la chaîne. Plus la quantité du produit final augmente, plus la réaction qui le produit ralentit. C'est ce qu'on appelle un mécanisme de contrôle par rétro-inhibition (plus l'effet augmente, plus la cause responsable de cet effet diminue).
En plus de remplir sa fonction propre dans la cellule, le produit F est un inhibiteur allostérique de l'enzyme 1. Si la concentration de F devient trop élevée dans la cellule, la voie métabolique qui le produit est alors bloquée. |
|
EXEMPLE |
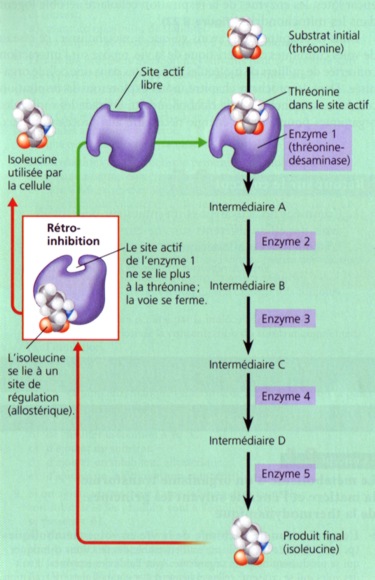
L'isoleucine est un acide aminé essentiel dans la synthèse des protéines. Si cet acide aminé vient à manquer, certaines cellules (les bactéries, par exemple) peuvent en fabriquer à partir d'un autre acide aminé, la thréonine. Si l'isoleucine est abondante dans la cellule, la plupart des thréonine-désaminases (l'enzyme 1 sur le dessin) sont inactivées. En effet, l'isoleucine est un effecteur inhibiteur de cette enzyme. Plus l'isoleucine est abondante, plus il y a de thréonine-désaminases inactivées et moins il y a d'isoleucine produit. Inversement, si l'isoleucine vient à manquer (la cellule utilise constamment cet acide aminé dans la synthèse de ses protéines), les isoleucines liées aux thréonine-désaminases auront tendance à s'en détacher ce qui aura pour effet de réactiver ces enzymes. La synthèse d'isoleucine augmente. Par ce mécanisme simple, le taux d'isoleucine dans la cellule demeure à peu près constant. Génial, non ?
|
|
|
||
|
|


 Qui
était Eduard Buchner
(1860-1917)? Quel rapport avec les enzymes? Décrivez
l'expérience pour laquelle l'histoire a retenu son
nom. Quel grand événement s'est produit dans
sa vie en 1907?
Qui
était Eduard Buchner
(1860-1917)? Quel rapport avec les enzymes? Décrivez
l'expérience pour laquelle l'histoire a retenu son
nom. Quel grand événement s'est produit dans
sa vie en 1907?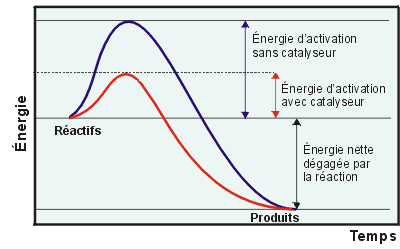

 Saviez-vous
qu'on peut faire du Jello avec des ananas en boîte mais
non avec des ananas frais? L'ananas frais contient en effet
une enzyme qui a la propriété de détruire
les protéines formant la gélatine du Jello (cette
enzyme brise les liaisons entre les acides aminés de
la gélatine). Le phénomène ne se produit
pas avec les ananas en conserve puisque les enzymes de ceux-ci
ont été dénaturées par la chaleur
lors de la stérilisation avant la mise en boîte.
Saviez-vous
qu'on peut faire du Jello avec des ananas en boîte mais
non avec des ananas frais? L'ananas frais contient en effet
une enzyme qui a la propriété de détruire
les protéines formant la gélatine du Jello (cette
enzyme brise les liaisons entre les acides aminés de
la gélatine). Le phénomène ne se produit
pas avec les ananas en conserve puisque les enzymes de ceux-ci
ont été dénaturées par la chaleur
lors de la stérilisation avant la mise en boîte.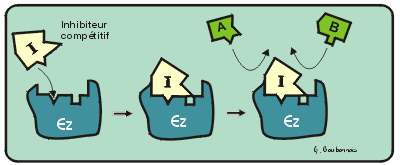
 Le
Zyclon-B de triste mémoire pour son utilisation dans
les camps de la mort nazis était constitué de
granules poreux imbibés d'acide cyanhydrique (HCN).
Le
Zyclon-B de triste mémoire pour son utilisation dans
les camps de la mort nazis était constitué de
granules poreux imbibés d'acide cyanhydrique (HCN).