 |
|
|
|
Acides aminés
| Structure | Rôles
| Enzymes | Nutrition
|
Structure
des protéines
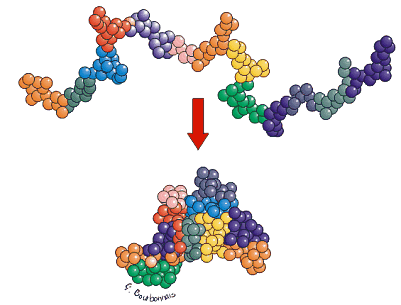
Toutes
les protéines sont formées d'une succession d'acides
aminés liés les uns aux autres dans un ordre précis.
Le lysozyme illustré ci-contre, par exemple, est formé
de l'union de 129 acides aminés. Le premier est la
lysine, le second, la valine, le troisième, la phénylalanine
... et le dernier, le 129e, la leucine.
|
129
ou 130 acides aminés?
À la page précédente,
le lysozyme illustré comportait 130 acides aminés
alors qu'il y en a 129 dans celui illustré ci-contre.
Il n'y a pas d'erreur. Le lysozyme de la page précédente
était du lysozyme humain,
alors que celui à droite vient du poulet.
En effet, d'une espèce à l'autre, et même
parfois à l'intérieur d'une même espèce,
une protéine donnée peut varier tout en conservant
toujours la même fonction. Plus les espèces sont
rapprochées évolutivement, plus leurs protéines
se ressemblent et plus elles sont éloignées,
plus il peut y avoir de différences. Le lysozyme humain,
par exemple, (130 acides aminés) est identique à
celui du chimpanzé. Par contre, il diffère par
51 acides aminés du lysozyme de poulet qui en comporte
129. On connaît bien le lysozyme de poulet puisqu'on
peut facilement l'extraire du blanc d'oeuf où il est
abondant.
Cliquez
sur la molécule de lysozyme du poulet (à droite)
pour en comparer les acides aminés avec ceux du lysozyme
humain.
|
La
séquence des acides
aminés d'une protéine (quel acide aminé est
le premier, le second, le troisième, ... , le dernier) constitue
ce qu'on appelle la structure primaire
de la protéine.
Les
radicaux des acides aminés (la partie qui varie d'un acide
aminé à l'autre) ont des propriétés
chimiques différentes. Certains sont hydrophobes,
d'autres hydrophiles, certains s'ionisent
négativement et d'autres positivement.
Certains radicaux peuvent former des liaisons chimiques
plus ou moins fortes avec d'autres radicaux. Il peut donc y avoir
dans une chaîne d'acides aminés des interactions
entre les radicaux. Certains se repoussent et d'autres se rapprochent
et forment des liens chimiques. La chaîne d'acides aminés
aura donc tendance à se replier sur elle-même pour
adopter une structure tridimensionnelle précise. Et
cette structure tridimensionnelle dépend avant tout de
la séquence des acides aminés formant la chaîne
(leur ordre si vous préférez).
|
|
| Les
protéines |
 Acides aminés
Acides aminés |
 Structure
Structure |
 Rôles
Rôles |
 Enzymes
Enzymes |
 Nutrition
Nutrition |
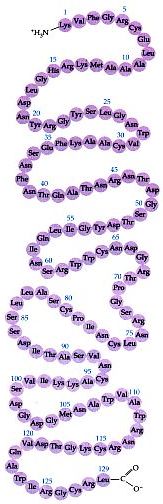
Séquence
du lysozyme de poulet.
Cette
séquence constitue la structure primaire du lysozyme.
Cliquez
sur la molécule pour faire apparaître les séquences
respectives du lysozyme de poulet et du lysozyme humain.
|
|
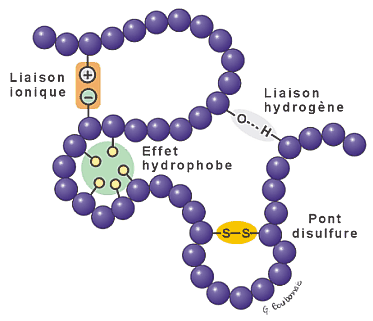
Quatre
grands types d'interactions interviennent dans le repliement de
la chaîne:
- L'effet
hydrophobe
Les
acides aminés dont les radicaux sont hydrophobes ont
plus d'affinité entre eux qu'avec les molécules
d'eau entourant la protéine. La chaîne a donc tendance
à se replier de façon à les regrouper entre
eux au centre de la molécule, sans contact direct avec
l'eau. Inversement, les acides aminés hydrophiles ont
tendance à se disposer à la périphérie
de façon à être en contact avec l'eau.
- Les
liaisons ioniques
Les radicaux qui s'ionisent positivement
forment des liaisons ioniques avec ceux qui s'ionisent négativement.
- Les
liaisons hydrogène
Vous n'avez quand même pas oublié
ce qu'est une liaison H ! Si oui, jetez un coup d'oeil sur
cet article de Wikipedia qui en donne un bref aperçu.
- Les
ponts disulfure
Deux des 20 acides aminés ont
des radicaux contenant un atome de soufre.
C'est le cas de la cystéine. Deux cystéines
peuvent former une liaison covalente entre elles par l'intermédiaire
de l'atome de soufre de leur radical. Cette liaison covalente
peut relier deux cystéines éloignées l'une
de l'autre sur la chaîne.
Comprenez-vous,
maintenant, pourquoi l'ordre des acides aminés est si important.
Certains acides aminés (pas tous) jouent un rôle
important dans la façon dont la chaîne se replie
en trois dimensions. Si on change un de ces acides aminés
par un autre, la protéine risque d'adopter une toute autre
forme. Et, comme nous le verrons plus loin, la fonction remplie
par la protéine dans la cellule dépend avant tout
de sa forme.
 Pourquoi
le changement d'un acide aminé par un autre peut-il parfois
modifier la forme finale de la protéine alors que dans
d'autres cas ce changement n'affecte pratiquement pas cette forme
finale ? Pourquoi
le changement d'un acide aminé par un autre peut-il parfois
modifier la forme finale de la protéine alors que dans
d'autres cas ce changement n'affecte pratiquement pas cette forme
finale ?
|
|
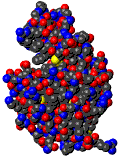
La chaîne
d'acides aminés formant le lysozyme se replie pour former
une structure plus compacte bien précise.
Quels
sont les deux acides aminés contenant du soufre? Voir : Amino
Acids
 D'après
vous, laquelle de ces forces est la plus forte, la plus difficile
à défaire? D'après
vous, laquelle de ces forces est la plus forte, la plus difficile
à défaire? |
La
structure primaire d'une protéine
détermine sa structure tertiaire.
|
|
|
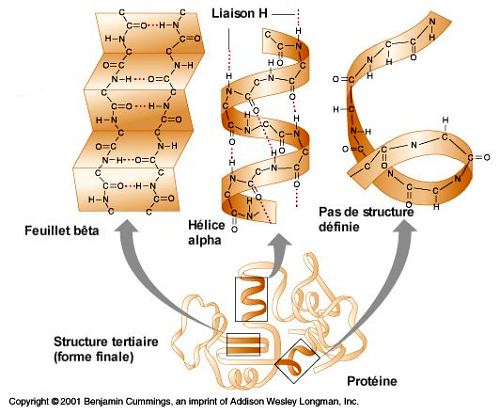
Certaines parties
de la chaîne d'acides aminés adoptent une structure
régulière appelée structure
secondaire. On reconnaît deux grands types de
structure secondaire :
- L'hélice
alpha
Dans la structure dite en hélice alpha, la chaîne
d'acides aminés prend la forme d'un tire-bouchon. Les
différentes spires sont stabilisées par des liaisons
hydrogène.
- Le feuillet
bêta
Dans
un feuillet bêta, il se forme des liaisons hydrogène
entre certains segments de la chaîne disposés parallèlement
les uns par rapport aux autres. L'ensemble forme comme une membrane
plissée.
Une protéine
est donc faite d'hélices alpha et de feuillets bêta
reliés par des segments qui n'ont pas de structure secondaire
particulière.
La forme finale
de la chaîne d'acides aminés, c'est à dire la
structure tridimensionnelle finale qu'adopte la chaîne d'acides
aminés, constitue la structure tertiaire
de la protéine.
|
|
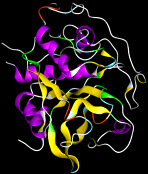
Sur cette représentation
d'une protéine, les hélices alpha apparaissent en
violet et les feuillets bêta en jaune.
|
| 
|
|
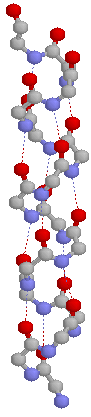 Hélice
alpha.
Hélice
alpha.
Notez les liaisons hydrogène qui stabilisent la structure. |
|
Voir : La
structure secondo-tertiaire d'une protéine
Plusieurs
protéines sont formées de l'assemblage de plusieurs
chaînes d'acides aminés. C'est le cas, par exemple,
de l'hémoglobine, la
protéine des globules rouges qui transporte l'oxygène.
L'hémoglobine est formée de deux chaînes
dites alpha (identiques l'une à l'autre) et de deux
chaînes dites bêta. On retrouve aussi, dans l'hémoglobine,
quatre groupements organiques, appelés hèmes,
contenant chacun un atome de fer (c'est à ce niveau que
se lie l'oxygène). L'hémoglobine est contenue dans
les globules rouges du sang. Chaque globule rouge contient quelque
chose comme 280 millions de molécules d'hémoglobine
(et il y a environ 5 millions de globules rouges par mm3
de sang).
Explorez
les molécules de myoglobine et d'hémoglobine
Ces
deux protéines transportent de l'oxygène. L'hémoglobine
est contenue dans les globules rouges du sang et la myoglobine,
dans les muscle. La page peut prendre quelques secondes à
se télécharger. Cliquez sur View animation
pour voirles diverses animations. Ne nécessite pas l'utilisation
de Chime.
La
catalase que nous avons étudiée
au laboratoire est formée de quatre chaînes identiques
contenant 502 acides aminés chacunes.
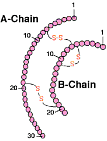 L'insuline,
l'hormone que doivent s'injecter tous les jours les diabétiques,
est une petite protéine formée de deux chaînes
différentes (l'une de 30 acides aminés et l'autre
de 21) reliées par des ponts disulfures. L'insuline,
l'hormone que doivent s'injecter tous les jours les diabétiques,
est une petite protéine formée de deux chaînes
différentes (l'une de 30 acides aminés et l'autre
de 21) reliées par des ponts disulfures.
La structure
finale résultant de l'assemblage des différentes
chaînes constitue la structure
quaternaire de la protéine. Évidemment,
les protéines qui ne sont formées que d'une seule
chaîne d'acides aminés n'ont pas de structure quaternaire.
|
|
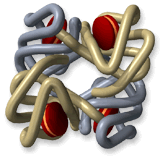
La
molécule d'hémoglobine.
L'hémoglobine est formée de deux chaînes dites
alpha et de deux chaînes dites
bêta (en bleu et or sur l'illustration).
Les hèmes contenant chacun un atome de fer sont représentés
par les disques rouges.
|
|
Dénaturation
d'une protéine
La forme finale
qu'adopte la protéine, sa structure tertiaire (ou quaternaire
pour celles formées de plusieurs chaînes), dépend
des forces responsables des liens reliant entre eux les radicaux
des acides aminés constituant sa structure primaire.
Dans certaines conditions, ces liens peuvent se défaire.
La protéine peut alors changer de forme. Comme nous le
verrons plus loin, la fonction biologique d'une protéine
est intimement liée à sa forme. La protéine
modifiée ne peut donc généralement plus assurer
sa fonction. Elle est alors dite dénaturée.
Les trois principaux facteurs pouvant provoquer la dénaturation
d'une protéine sont:
- La
chaleur
L'agitation thermique a pour effet de briser les faibles liaisons
hydrogène reliant les radicaux de la chaîne.
- Un
pH extrême
La plupart des protéines se dénaturent en milieu
trop acide ou trop alcalin.
- Un
milieu très concentré en électrolytes (ions)
Une protéine
peut également se dénaturer si on la place dans
un solvant organique. Les régions hydrophobes se tournent
alors vers l'extérieur alors que les hydrophiles se rassemblent
au centre de la molécule (la molécule se retourne
comme une chaussette). Certaines substances chimiques peuvent
aussi réagir avec la protéine et briser les liaisons
ioniques, les ponts disulfure ou même les liens entre les
acides aminés.
|
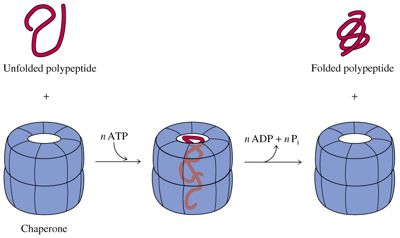
Des
chaperons pour les protéines
Dans
la cellule, chaque protéine est fabriquée
par l'assemblage un à un des acides aminés
de la structure primaire. Au fur et à mesure que
s'allonge la chaîne, elle se replie en fonction des
interactions entre les acides aminés la constituant.
Cependant, il peut arriver que la chaîne d'acides
aminés interagisse avec d'autres protéines
présentes dans le milieu (les protéines en
solution peuvent former entre elles des liaisons conduisant
à la formation d'une solution gélatineuse)
ce qui peut perturber le bon repliement de la protéine.
Des protéines spéciales, découvertes
récemment, les chaperonines
(on en connaît actuellement 17 sortes), assurent le
bon repliement des protéines synthétisées.
|
|
|
Pourquoi
le blanc d'oeuf coagule-t-il lorsqu'on le chauffe? Et pourquoi
ne revient-il pas liquide lorsqu'on le refroidit? La réponse
à ces questions a rapport avec les interactions entre
les acides aminés des protéines de l'oeuf.
Réponse complète sur
ce site.
Regardez
aussi cette animation. |
| La chaleur
est mortelle pour les organismes vivants puisqu'elle provoque
la dénaturation de leurs protéines. |

Chaperonine
|
 |
©
Gilles Bourbonnais / Cégep de Sainte-Foy
|









 L'
L'

